আজ আমরা যে পরমাণু মডেল সম্পর্কে ধারণা রাখি তার সূত্রপাত হয়েছে আজ থেকে প্রায় দুই হাজার চার শ বছর আগে। অর্থাৎ যীশু খ্রীষ্টের জন্মেরও আগে। দার্শনিক ধারণায় তৈরি পরমাণু মডেল পরীক্ষালব্ধ ফলাফল দ্বারা প্রভাবিত হয়ে বহুবার বিবর্তিত হয়েছে। বিভিন্ন বিজ্ঞানীর অক্লান্ত পরিশ্রমের ফলাফল হল বর্তমান পরমাণু মডেল।
Table of Contents
Toggleপ্রাচীন গ্রীক মতবাদ
পরমাণু কথার ইংরেজি হল 'atom' যা এসেছে গ্রীক শব্দ 'atomos' থেকে। এর মানে হল 'অবিভাজ্য'। গ্রীক দার্শনিক Democritus (c.460–c.370 BC) বলেন পরমাণু অবিনশ্বর ও চিরন্তন। এটি কঠিন, অসংনম্য, সর্বদা গতিশীল যতক্ষণ না থামানো যায়। পদার্থভেদে পরমাণুর আকার ও ধর্ম পরিবর্তন হয়। ডেমোক্রিটাস আরও বলেন যে পদার্থকে ভাঙ্গলে অবশেষে অবিভাজ্য কণা পাওয়া যাবে।
এদিকে Aristotle (384-322 BC) আবার ডিমোক্রিটাসের পরমাণুবাদ সংক্রান্ত ধারণার বিরোধিতা করেন। অ্যারিস্টটল বৈজ্ঞানিক যুক্তির চেয়ে দার্শনিক দৃষ্টিভঙ্গির ওপর জোর দিয়েছিলেন। ডেমোক্রিটাস যেখানে বিশ্বাস করতেন শূন্য স্থান (vacuum) ছাড়া বস্তু চলাচল করতে পারে না। সেখানে অ্যারিস্টটল শূন্যতার ধারণাই করতে পারেন নি। অ্যারিস্টটলের ধারণা ইউরোপে মধ্যযুগ পর্যন্ত টিকে ছিল। রোমান ক্যাথলিক ধর্মতত্ত্ববিদরা ডেমোক্রিটাসকে বস্তুবাদী ও নাস্তিক বলে তার তত্ত্বকে খারিজ করে দেয়।
এরপর Epicurus (341–270 BCE); ডেমোক্রিটাসের ধারণাকে ব্যবহার করে তৎকালীন সমাজের কুসংস্কার চিন্তাধারাকে দূর করার চেস্টা করেন। তিনি বলেন সমগ্র বিশ্ব পরমাণু ও শূন্য স্থান দিয়ে তৈরি। পদার্থ যেহেতু কিছু প্রাকৃতিক নিয়ম মেনে চলে সেজন্য ঈশ্বরও প্রকৃতির নিয়মের মধ্যে পরে যায়।
গ্রীক সভ্যতায় যে পরমণুবাদ তৈরি হয়েছে তা পুরোটাই দার্শনিক দৃষ্টিভঙ্গি সৃষ্টি। কোনোরকম বৈজ্ঞানিক পরীক্ষা বা পর্যবেক্ষণ ছিল না। তাদের মতবাদের সত্যতা যাচাইয়ের কোনো সাধন ছিল না। সেজন্য সেই সময়ের পরমাণু সম্পর্কে ধারণা খুবই সীমিত ছিল। এরপর প্রায় আঠারো শ বছর পরমাণু নিয়ে তেমন উল্লেখযোগ্য পরিবর্তন বা আবিষ্কার হয়নি। ফরাসী ধর্মযাজক Pierre Gassendi (1592–1655); এপিকিউরাসের-এর পরমাণুবাদকে কিছুটা পরিবর্তন করেন। তিনি বলেন পরমাণু ঈশ্বরের সৃষ্টি, পরমাণুর সংখ্যা অসংখ্য হলেও আসীম নয়। ইনিই প্রথম "molecule” শব্দটি প্রবর্তন করেন। এর অর্থ হল "পরমাণুর সমষ্টি"।
পরবর্তীতে রসায়নবিদ Robert Boyle (1627–1691) ও পদার্থবিদ Isaac Newton (1642–1727) দুজনেই " পরমাণুবাদ "-এর সমর্থন করেন। এই রবার্ট বয়েলই কিন্তু গ্যাসের চাপ ও আয়তনের সম্পর্ক আবিষ্কার করেছিলেন। সপ্তদশ শতকের শেষের দিকে বেশিরভাগ বিজ্ঞানী পরমাণু ধারণাকে গ্রহণ করে নেয়। নিউটন তার "Opticks" বইয়ে পরমাণু সম্পর্কে যা বলেছেন তা বাংলায় তর্জমা করলে দাঁড়ায়-"এই সব বিষয় বিবেচনা করে আমার মনে হয়েছে ঈশ্বর শুরুতে বিভিন্ন আকারের কঠিন, ভরযুক্ত, শক্ত, অভেদ্য, গতিশীল পদার্থ তৈরি করেছেন। "[1]
ডালটনের পরমাণুবাদ
1805 সালে ডালটন গ্যাসের আংশিক চাপ সংক্রান্ত সূত্র প্রতিষ্ঠা করেন। পরবর্তীতে তিনি অনুধাবন করেন ডেমোক্রিটাসের তত্ত্বটি অনেকটাই সত্য ছিল। তিনি বলেন- i) পরমাণু অবিভাজ্য।, ii) একই পদার্থের পরমাণুগুলি দেখতে একই রকম।, iii) ভিন্ন পদার্থের পরমাণু ধর্মেও ভিন্ন হয়।, iv) বিভিন্ন পরমাণু পূর্ণ সংখ্যার অনুপাতে যুক্ত হয়ে যৌগ তৈরি করে।

ক্যাথোড রশ্মির আবিষ্কার
1854 সালে ক্যাথোড রশ্মি নিয়ে গবেষণা শুরু হয়। জার্মান বিজ্ঞানী Julius Plucker ও তার সহযোগী Heinrich Geissler 1858 সালে বায়্যশূন্য নলে উচ্চবিভব প্রয়োগ করে জানতে পারেন ক্যাথোড থেকে কিছু একটা বের হচ্ছে। এরপর স্যার William Crookes ক্যাথোড টিউব নিয়ে আরোও ভালো গবেষণা করেন। 1879 সালে তিনি দেখান ক্যাথোড রশ্মি অ্যানোডের দিকেই ধাবিত হয়। এটি চৌম্বক ক্ষেত্র দ্বারা প্রভাবিত হয় ঠিক যেমন ঋণাত্মক আধান প্রভাবিত হয়। ক্রুক্স অনুমান করেছিলেন ক্যাথোড রশ্মি বোধহয় পদার্থের চতুর্থ অবস্থা। যা পরবর্তীতে J J Thomson এর ইলেকট্রন আবিষ্কার দ্বারা ভুল প্রমাণিত হয়।[2]
ক্যাথোড রশ্মি নিয়ে জার্মান এবং ব্রিটিশ বিজ্ঞানীরা দুটি দলে বিভক্ত হয়ে গিয়েছিল। জার্মান বিজ্ঞানীদের মতে ক্যাথোড রশ্মি হল এক ধরনের বিকিরণ। অন্যদিকে ব্রিটিশরা ভাবতেন এটা কোনো আহিত কণা। বিজ্ঞানী Hertz পরীক্ষা করে প্রমাণ করতে ব্যর্থ হন যে ক্যাথোড রশ্মি হল আহিত কণা। আসলে ক্যাথড রশ্মি তৈরির জন্য যতটা নিম্নচাপ হওয়া উচিত ছিল Hertz তার পরীক্ষায় ততটা আনেননি। 1897 সালে থমসন অনেকগুলো পরীক্ষা করে এই সিদ্ধান্তে আসেন যে ক্যাথোড রশ্মি হল আহিত কণা। তিনি ক্যাথোড রশ্মির ওপর তড়িৎক্ষেত্র ও চৌম্বকক্ষেত্র এক সাথে প্রয়োগ করে এর বেগ নির্ণয় করতে সমর্থ হন। থমসনের পরীক্ষা থেকে জানা যায় যে প্রথমত, ক্যাথোড রশ্মির e/m (আধান ও ভরের অনুপাত)-এর মান হাইড্রোজেনের তুলনায় 1000 গুণেরও বেশি। দ্বিতীয়ত, তড়িৎদ্বার হিসেবে যে ধাতুই ব্যবহার করা হোক না কেন প্রতিক্ষেত্রে একই ধরনের ক্যাথোড রশ্মি নির্গত হয়। এর অর্থ হলো ক্যাথোড রশ্মি হল এক মৌলিক কণা যা সকল পদার্থে উপস্থিত।

থমসন কিন্ত ক্যাথোড রশ্মিকে শুধু কণিকা বলতেন যা ঋণাত্মক আধানে আহিত। পরবর্তীতে George Johnstone Stoney- এর দেওয়া “ইলেকট্রন” নামটি বেশি প্রচলিত হয়। অবশ্য “ইলেকট্রন” শব্দটি 1891 সাল থেকেই প্রচলিত ছিল।
গ্যাসের তড়িৎ পরিবহন নিয়ে অসামান্য গবেষণার জন্য থমসন 1906 সালে নোবেল পুরস্কারে ভূষিত হন।
তাহলে জানা গেল পরমাণুর অভ্যন্তরে ঋণাত্মক প্রকৃতির একটি কণিকা রয়েছে যার নাম ইলেকট্রন। কিন্তু পরমাণু তো নিস্তড়িত। তারমানে পরমাণুর অভ্যন্তরে ধনাত্মক কিছু রয়েছে। মূল প্রশ্ন দাঁড়ালো- পরমাণু আসলে দেখতে কেমন?
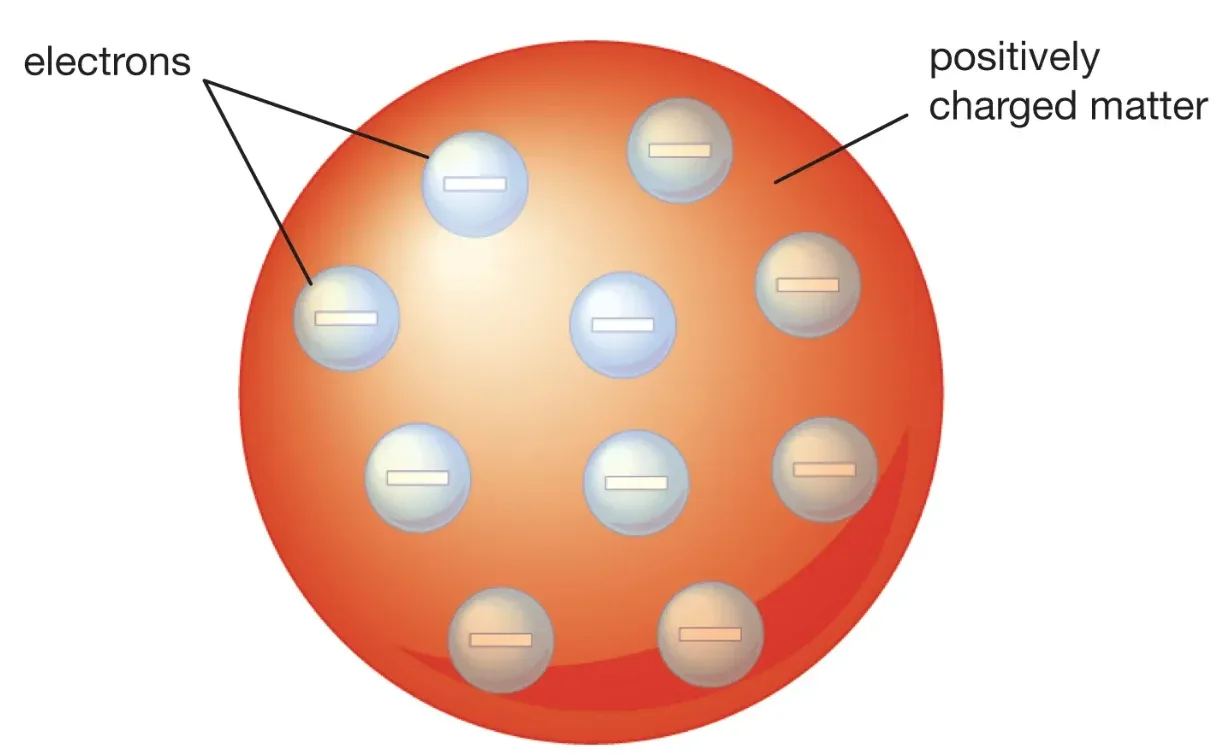
থমসনের ধারণা অনুযায়ী পরমাণু হল এক ধনাত্মক আধার। এর ভিতরে ইলেকট্রন কণা ছুটে বেড়াচ্ছে। অনেকটা plum pudding-এর মতো। আমরা কল্পনা করতে পারি তরমুজের মতো। সমগ্র তরমুজটা হল ধনাত্মক। এর বীজগুলো ইলেকট্রন কণা; তবে গতিশীল। পরমাণুর এরূপ গঠনকে থমসনের-এর 'পাম পুডিং মডেল' বলা হয়। যদিও এই মডেল দিয়ে পরমাণুর স্থায়ীত্ব-এর ব্যাখ্যা করা যায় না বলে পরবর্তীতে মডেলটি বাতিল হয়।[3]
নিউক্লিয়াসের আবিষ্কার
1899 সালে নিউজিল্যান্ডের বিজ্ঞানী Ernest Rutherford তেজস্ক্রিয়তা নিয়ে গবেষণা করে তিন প্রকারের কণা খুঁজে পান। এদের নাম দেন আলফা (α), বিটা (β) ও গামা (γ)। 1908 সালের দিকে আরও গবেষণার পর রাদারফোর্ড জানতে পারলেন আলফা কণা আসলে হিলিয়াম আয়ন। মনে রাখতে হবে এখনো কিন্তু বিজ্ঞানীরা পাম পুডিং মডেল অনুযায়ী পরমাণুর গঠন সম্পর্কে ধারণা রাখতেন।
1905 সালের দিকে রাদারফোর্ড পাম পুডিং মডেলের সত্যতা যাচাইয়ের পরীক্ষা শুরু করেন। রাদারফোর্ড কিন্তু থমসনের-এর ছাত্র ছিলেন। 1909 সালে রাদারফোর্ড ও তার সহযোগীরা মিলে 'সোনার পাতের ওপর আলফা কণার বিক্ষেপণ'-এর বিখ্যাত পরীক্ষাটি করেন।
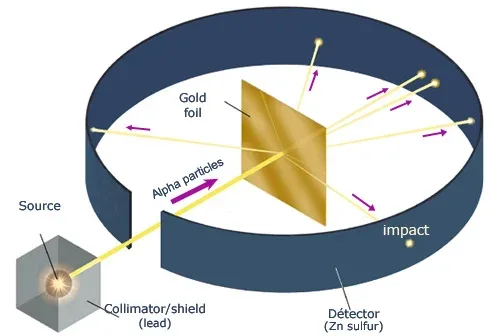
এই পরীক্ষায় একটি অত্যন্ত পাতলা সোনার পাতে আলফা কণা নিক্ষেপ করা হয়। দেখা যায় যে বেশিরভাগ আলফা কণা পাতটি ভেদ করে চলে যায়। খুবই কম সংখ্যক আলফা কণা এদিক ওদিক বিক্ষিপ্ত হয়। এই পরীক্ষার সিদ্ধান্তগুলি ছিল- (i) পরমাণুর বেশিরভাগ স্থান ফাঁকা।, (ii) পরমাণুর সমগ্র ভর পরমাণুর কেন্দ্রে সুক্ষ্ম স্থানে অবস্থান করে। একে নিউক্লিয়াস বলা হয়।, iii) নিউক্লিয়াস ধনাত্মক প্রকৃতির।
তাহলে ইলেকট্রনগুলি কোথায় রয়েছে?
রাদারফোর্ডের নতুন পরমাণু মডেল অনুযায়ী ইলেকট্রনগুলি নিউক্লিয়াসের চারপাশে বিভিন্ন কক্ষপথে ঘুরছে। অনেকটা সূর্যের চারপাশে গ্রহরা যেভাবে ঘুরছে।
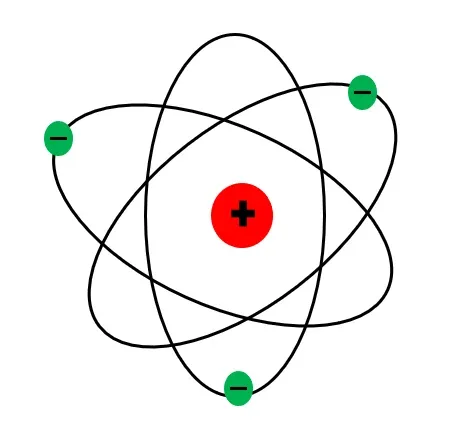
রাদারফোর্ডের এই আবিষ্কার পরমাণুর গঠন সম্পর্কে এক যুগান্তকারী ধারণার সৃষ্টি করে। রাদারফোর্ড আরও পরমাণু নিউক্লিয়াস ও তেজস্ক্রিয়তা নিয়ে গবেষণা করতে থাকেন। 1908 সালে রাদারফোর্ডকে নোবেল পুরুস্কারে ভূষিত করা হয় তেজস্ক্রয়তা সম্পর্কিত গবেষণার জন্য। [4]
বোরের পরমাণু মডেল
রাদারফোর্ড যে পরমাণু মডেলটি দিয়েছিলেন তার মধ্যে কিছু অসম্পূর্ণতা ছিল। যেমন- কোনো আধান যদি তড়িৎক্ষেত্রে গতিশীল হয় তাহলে সেটি তড়িৎচুম্বকীয় তরঙ্গ শোষণ বা বর্জন করবে। পরমাণুর ক্ষেত্রে ইলেকট্রন কিন্তু ধনাত্মক আধানের আহিত নিউক্লিয়াসের প্রভাবে বৃত্তাকার পথে গতিশীল। তাহলে এক্ষেত্রেও ইলেকট্রন দ্বারা তড়িৎচুম্বকীয় তরঙ্গ বিকিরণ করার কথা এবং শক্তি বিকিরণ করে ইলেকট্রনটি নিউক্লিয়াসে আপতিত হবে। অবশেষে ধনাত্মক নিউক্লিয়াস ও ঋণাত্মক ইলেকট্রন একে অপরকে বিনষ্ট করে দেবে। মোদ্দা কথা হলো, রাদারফোর্ডের পরমাণু মডেল অনুযায়ী পরমাণু অস্থায়ী। কিন্তু পরমাণু তো স্থায়ী! এর সমাধান দেন বিজ্ঞানী Niels Bohr।
1911 সালে বোর গবেষণা করার জন্য J J Thomson-এর কাছে যান। কিন্তু তিনি থমসনকে সেরকম সন্তুষ্ট করতে পারেননি। পরবর্তীতে তিনি রাদারফোর্ডের কাছে পোস্ট ডক্টরেট করার সুযোগ পান। সেখানে বোর পরমাণুর গঠন সম্পর্কিত গবেষণা করেন। 1913 সাল তিনি তার পরমাণু মডেল প্রকাশিত করেন। এর জন্য তিনি 1901 সালে ম্যাক্স প্লাঙ্কের আবিষ্কৃত ‘কণা তত্ত্ব’-এর সাহায্যে নেন। বোর বলেন ইলেকট্রনগুলি যখন কোনো কক্ষে থাকে তখন সেটি কোনো প্রকার শক্তি গ্রহণ বা বর্জন করবে না। নির্দিষ্ট পরিমাণ শক্তি পেলেই সেটি উচ্চকক্ষে সংক্রামিত হবে অথবা নির্দিষ্ট পরিমাণ শক্তি ত্যাগ করে সেটি নিম্নকক্ষে গমন করবে।
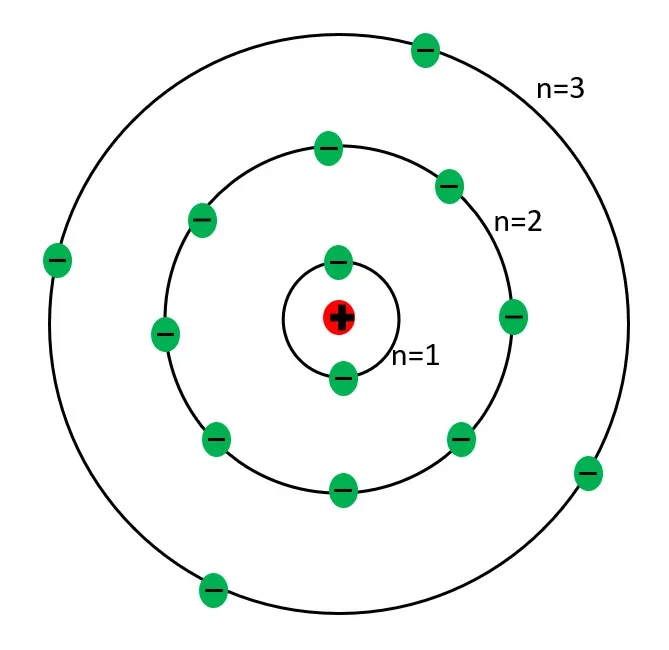
এই তত্ত্বের সাহায্যে পরবর্তীতে রেখা বর্ণালী সৃষ্টি হওয়ার কারণকেও ব্যাখ্যা করা যায়। পরমাণু ও বিকিরণ সংক্রান্ত গবেষণা সেই সঙ্গে কোয়ান্টাম মেকানিক্সে বিশেষ অবদানের জন্য 1922 সালে বোর নোবেল পুরস্কারে সম্মানিত হন।[5],[6]
প্রোটন আবিষ্কার
এবার একটু কয়েক বছর পেছনের দিকে যাওয়া যাক। 1886 সালে জার্মান বিজ্ঞানী Eugen Goldstein ক্যাথোড রশ্মি নিয়ে পরীক্ষা করার সময় লক্ষ্য করেন ক্যাথোড প্লেটের মধ্যে যদি ছিদ্র করা হয় সেই ছিদ্র দিয়ে কিছু রশ্মি নির্গত হয়। এর নাম তিনি দিয়েছিলেন ক্যানাল রশ্মি। পরবর্তীতে আরও গবেষণা করে জানা যায় এটি হল ধনাত্মক আহিত কণা। যা নির্দেশ করে পরমাণুতে ধনাত্মক বলেও কিছু রয়েছে।
এবার চলে আসি রাদারফোর্ড-এর কাছে। 1917 সালে রাদারফোর্ড নাইট্রোজেন গ্যাস চেম্বারে আলফা কণা দিয়ে আঘাত করেন এবং তিনি লক্ষ্য করেন যে নাইট্রোজেন পরমানুটি অক্সিজেন পরমাণুতে রূপান্তরিত হয় এবং একটি ধনাত্মক আধান নির্গত হচ্ছে। ধনাত্মক আধানের গতিপথ দেখে বোঝা গেল এটি আসলে হাইড্রোজেন আয়ন।
_7^{14}N + \alpha (_2^4He^{2 +})\rightarrow _8^{17}O + _1^{1}H^+(proton)
রাদারফোর্ড এই পরীক্ষা দ্বারা সিদ্ধান্তে আসেন যে হাইড্রোজেন আয়ন হল আরেক ধরণের মৌলিক কণিকা। 1920 সালে একে প্রোটন হিসেবে অভিহিত করা হয়। যদিও প্রোটনকে এখন আর মৌলিক কণিকা ধরা হয় না।
নিউট্রন আবিষ্কার
প্রোটন ও ইলেকট্রনের আধান সমান কিন্তু বিপরীত। সেজন্য নিশ্চয়ই কোনো নিস্তড়িত পরমাণুতে সমান সংখ্যক প্রোটন ও ইলেকট্রন থাকবে। তবে এই দুই কণিকার ভর আলাদা। একটি প্রোটন একটি ইলেকট্রনের তুলনায় 1836 গুণ ভারী। যদি কোনো পরমাণুর প্রোটন ও ইলেকট্রনের ভর নেওয়া যায় তাহলে লক্ষ্য করা যায় যে এর মান পরমাণুর প্রকৃত ভরের তুলনায় অনেক কম। এর অর্থ হলো পরমাণুতে নিশ্চয়ই কোনো কণিকা রয়েছে যা নিস্তড়িত।
ব্যাপারটি নিয়ে রাদারফোর্ড নিজেও চিন্তা করেছিলেন। তিনি লক্ষ্য করেছিলেন আলফা কণার আধান +2 হলেও এর ভর হাইড্রোজেনের প্রায় 4 গুণ। রাদারফোর্ড এই অনাবিষ্কৃত কণাকে নাম দেন ‘নিস্তড়িত প্রোটন (neutral proton)’।
1932 সালে ব্রিটিশ বিজ্ঞানী James Chadwick আলফা কণার সঙ্গে বেরেলিয়াম পরমাণু সংঘাত ঘটিয়ে একটি কণা আবিষ্কার করেন যা তড়িৎক্ষেত্র ও চৌম্বকক্ষেত্র কোনটিতেই বিক্ষিপ্ত হয় না। একে তিনি ‘নিউট্রন’ নামকরণ করেন।
_4^9Be + \alpha (_2^4He^{2 +})\rightarrow_6^{12}C+_0^1n(neutron)
এই আবিষ্কারের ফলে পরমাণুর নিউক্লিয়াস সম্পর্কে ধারণা অনেকটা পরিষ্কার হয়। 1935 সালে চ্যাডউইক নোবেল পুরস্কারে সম্মানিত হন নিউট্রন করা আবিষ্কারের জন্য।
তাহলে বোঝা গেল, পরমাণুর অভ্যন্তরে তিনটি কণিকা রয়েছে। ইলেকট্রন, প্রোটন ও নিউট্রন। ইলেকট্রন নিউক্লিয়াসের চারপাশে নির্দিষ্ট কক্ষপথে অবস্থান করে। প্রোটন ও নিউট্রন নিউক্লিয়াসে অবস্থান করে। এখন প্রশ্ন হল, তাহলে কি পরমাণুর সঠিক গঠন সম্পর্কে ধারণা পাওয়া গেল? এক কথায় উত্তর; না। এরপরে আরও গবেষণায় পাওয়া যায় কক্ষপথগুলি ক্ষুদ্র ক্ষুদ্র উপকক্ষে বিভক্ত। নিউক্লিয়াসে প্রোটন ও নিউট্রনের মধ্যে নিউক্লিয় বল ক্রিয়া করে। নিউট্রন, প্রোটন আবার কোয়ার্ক দিয়ে তৈরি। পরমাণুর বিঘটনে ইলেকট্রনের প্রতি-কণা পজিট্রন পাওয়া যায়। আরো কত কী! তবে এতটুকু বলা যায় পরমাণুর মূল গঠনগত কণিকা তিনটি হল ইলেকট্রন প্রোটন ও নিউট্রন।
তথ্যসূত্র-
[1] https://www.britannica.com/science/atom/Development-of-atomic-theory
[2] https://nationalmaglab.org/magnet-academy/history-of-electricity-magnetism/pioneers/william-crookes/
[3] https://www.phy.cam.ac.uk/history/electron/autobiography
[4] https://www.bbc.co.uk/bitesize/guides/zxkxfcw/revision/2
[5] https://ahf.nuclearmuseum.org/ahf/profile/niels-bohr/
[6] https://www.pbs.org/wgbh/aso/databank/entries/bpbohr.html






 ABC প্রিজমের প্রতিসারক কোণ ∠A। PQ রশ্মি AC তলে ∠
ABC প্রিজমের প্রতিসারক কোণ ∠A। PQ রশ্মি AC তলে ∠